Publikacja wyłącznie w języku angielskim
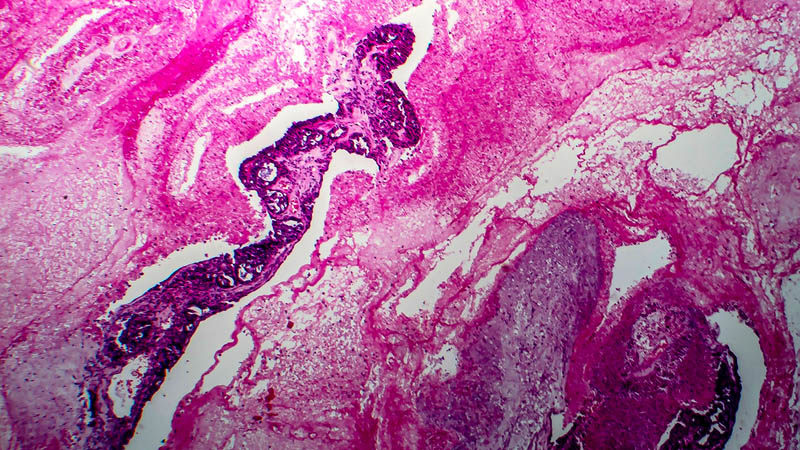
Klinowa resekcja brzegu wątroby wykonywana przez ginekologa onkologa w trakcie operacji
cytoredukcyjnej w zaawansowanym raku jajnika jest procedurą skuteczną oraz bezpieczną
Bartłomiej Banaś, Piotr Kołodziejczyk, Kazimierz Pityński, Michał Mleko, Piotr Richter
Curr Gynecol Oncol 2021, 19 (2), p. e33–e40
Kwestionariusze nomotetyczny EORTC IN-PATSAT 32 i idiograficzny GAS w ocenie leczenia operacyjnego przez pacjentki z rakiem endometrium
Joanna Trawińska, Joanna Skręt-Magierło, Renata Raś, Bogusław Gawlik, Andrzej Skręt, Sławomir Januszek, Edyta Barnaś
Curr Gynecol Oncol 2021, 19 (1), p. e1–e7
Stężenie B-hCG i H-hCG u pacjentek z ciążową neoplazją trofoblastu
Maryam Nakhaie Moghadam, Sonia Nourkhomami, Leila Mousavi Seresht, Helena Azimi, Somayeh Bolandi, Tahereh Zavari, Zohreh Yousefi
Curr Gynecol Oncol 2020, 18 (2), p. e34–e38
Toksyczność immunoterapii w przerzutowych czerniakach sromu i pochwy: retrospektywne badanie kohortowe
Sheida Naderi-Azad, Faisal Sickander, Rossanna C. Pezo
Curr Gynecol Oncol 2020, 18 (2), p. e39–e42
Analiza wpływu wskaźnika masy ciała na przeżycie całkowite u pacjentek z czerniakiem sromu, pochwy i innych czerniaków błon śluzowych: retrospektywne badanie kohortowe
Sheida Naderi-Azad, Faisal Sickandar, Rossanna C. Pezo
Curr Gynecol Oncol 2020, 18 (2), p. e43–e45
Rola długich niekodujących RNA (lncRNA) w raku jajnika
Dorota Gumiela
Curr Gynecol Oncol 2020, 18 (2), p. e46–e56
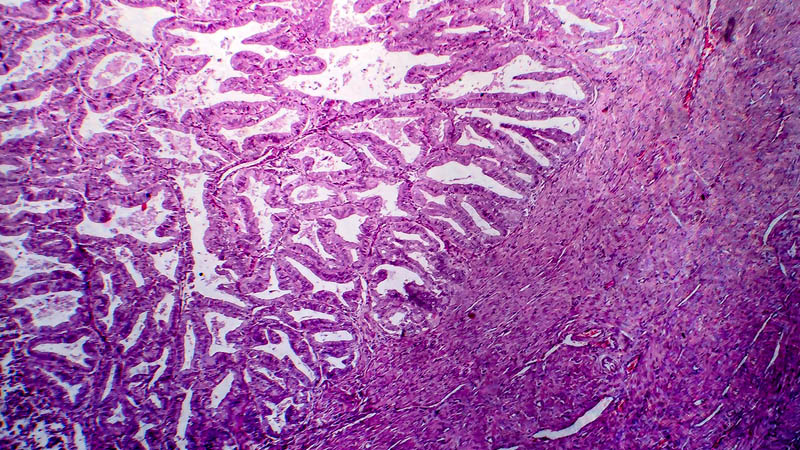
Mięsaki macicy: 7-letnie doświadczenie ośrodka o trzecim stopniu referencyjności
Mehmet Hakan Yetimalar, Derya Kilic, Seyran Yigit
Curr Gynecol Oncol 2020, 18 (1), p. e1–e6
Postępowanie w przypadku ciąży w bliźnie po cięciu cesarskim: leczenie farmakologiczne czy chirurgiczne? Kiedy i jak? Przegląd piśmiennictwa
Gülşah Selvi Demirtaş
Curr Gynecol Oncol 2020, 18 (1), p. e7–e11
Rola immunoterapii w leczeniu chorób nowotworowych
Teresa Wolniewicz, Jakub Franke, Joanna Kacperczyk-Bartnik, Paweł Bartnik, Anna Wójcicka
Curr Gynecol Oncol 2020, 18 (1), p. e12–e16
Laparoskopowa radykalna trachelektomia oszczędzająca nerwy: retrospektywna analiza czterech pacjentek
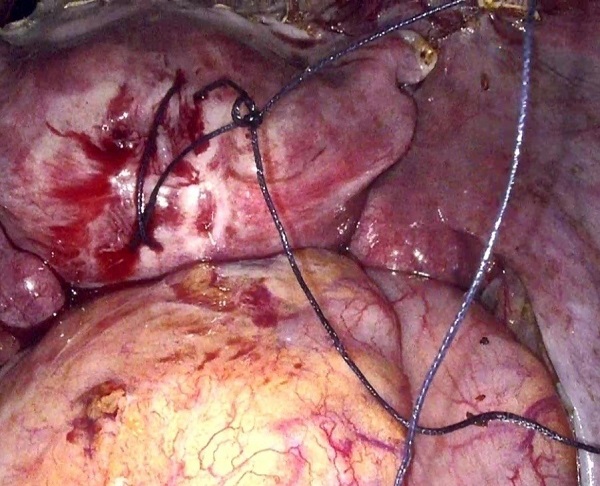
Shailesh Puntambekar, Kshitij Manerikar, Mihir Chitale, Arjun Goel, Deep Bhadra, Ravindra Sathe, Mangesh Panse
Curr Gynecol Oncol 2020, 18 (1), p. e21–e27
Rzadki przypadek endometriozy umiejscowionej w bliźnie po nacięciu krocza
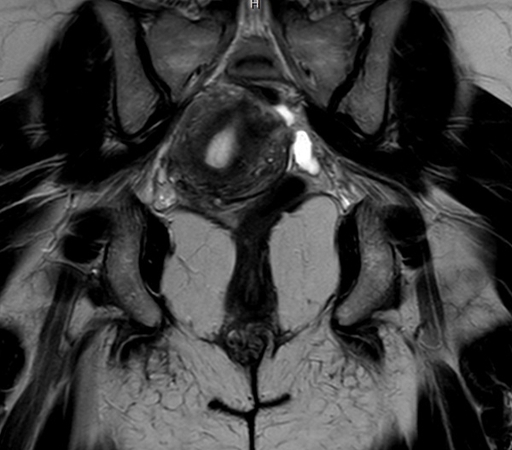
Eftekhar Hassan Al-Ojaimi, Janan Nabeel Alajaimi
Curr Gynecol Oncol 2020, 18 (1), p. e28–e33